Vorlesung Chemie der Metalle
9. Übergangsmetalle II
II. Nebengruppe/12. Gruppe/Zink-Gruppe
| alte Nomenklatur: (Link) |
III. NG |
IV. NG |
V. NG |
VI. NG |
VII. NG |
VIII. NG |
I. NG |
II. NG |
| neue Nomenklatur: |
3. Gr. |
4. Gr. |
5. Gr. |
6. Gr. |
7. Gr. |
8. Gr. |
9. Gr. |
10. Gr. |
11. Gr. |
12. Gr. |
| 3d |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
| 4d |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
| 5d |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Unterkapitel: (im Aufbau, bisher nur Materialien)
- Allgemeines
- Zink
- Element, Vorkommen und Gewinnung, Legierungen
- Halogenide
- Chalkogenide
- Sonstige Verbindungen
- Cadmium
- Element, Vorkommen und Gewinnung
- Halogenide
- Chalkogenide
- Sonstige Verbindungen
- Quecksilber
- Element, Vorkommen und Gewinnung
- Halogenide
- Chalkogenide
- Sonstige Verbindungen
Allgemeines
Zur II. Nebengruppe, 12. Gruppe oder Zink-Gruppe
gehören die Elemente Zink (Zn), Cadmium (Cd) und Quecksilber (Hg) (englisch:
Mercury). Bei Zn und Cd sind praktisch nur die zweiwertigen Ionen bekannt,
deren Salze sich sehr ähnlich wie Mg- oder Ca-Salze verhalten.
Für Zn2+ wird allerdings meist eine tetraedrische Koordination gegen
Oxid- oder Sulfid-Ionen gefunden (ZnO, ZnS: Zinkblende bzw. Wurtzit).
Zink
Element, Vorkommen und Gewinnung, Legierungen
 |
| 9.2.1. Elementares Zink |
Zink ist, neben Kupfer, Legierungsbetandteil von Messing.
(s. Kap. 4.4. der Vorlesung Intermetallische Phasen
sowie den Versuch 'Geld fälschen' im Kupfer-Kapitel dieser Vorlesung).
Chalkogenide
Cadmium
Element, Vorkommen und Gewinnung
 |
| 9.2.2. Stange aus elementarem Cadmium |
Chalkogenide
Die Sulfide und Selenide, die sowohl auf den Kationen- als auch auf den Anionen-Positionen
substituierbar sind, waren früher verwendete brilliante gelbe bis rote, allerdings sehr toxische
Pigmente.
Die Farbigkeit beruht hier auf Übergängen zwischen dem Valenzband und dem Leitungsband
der Festkörper, was man sofort daran merkt, dass sie beim Auflösen
der Salze verschwindet (vgl. Analytik: Sulfide im Trennungsgang).
 |
 |
 |
| Gelb 6 GS (Zn,Cd)S |
Orange 3 RS Cd(S,Se) |
Rot BS Cd(S,Se) |
| Abb. 9.2.X. Einige 'Cadmopur'-Pigmente, Fa. Bayer |
Quecksilber
Element, Vorkommen und Gewinnung
 |
| 9.12.3. Zinnober (Quecksilbersulfid) |
Halogenide
| ⚗ Hg-Nachweis mit Ammoniak
(19MB|MP4|H264) |
|
|
Bei Zugabe von Ammoniak zu Kalomel erfolgt Disproportionierung gemäß:
Hg+I2Cl2 + NH3 ⟶
Hg+IINH2Cl + Hg0 (schwarz) + HCl
|
 |
 |
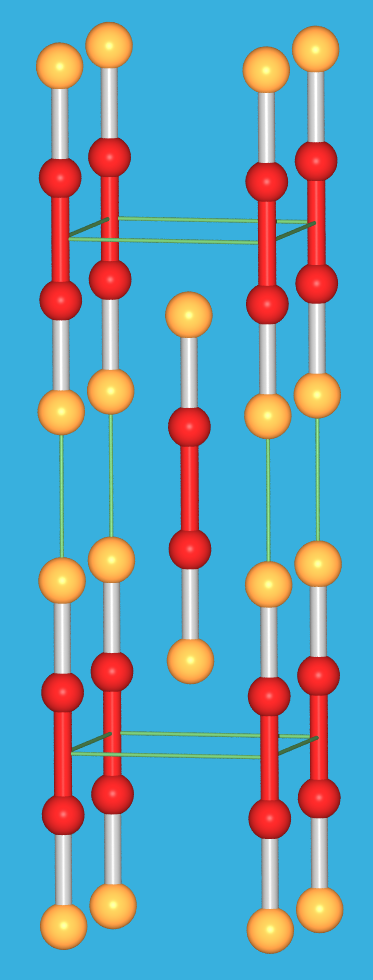
| 9.2.3. Kristallstruktur von
Kalomel, Hg2Cl2: Der Feststoff besteht aus Hg2Cl2-Molekülen, in
denen der Hg-Hg-Abstand nur 259.5 pm beträgt.
‣VRML
|
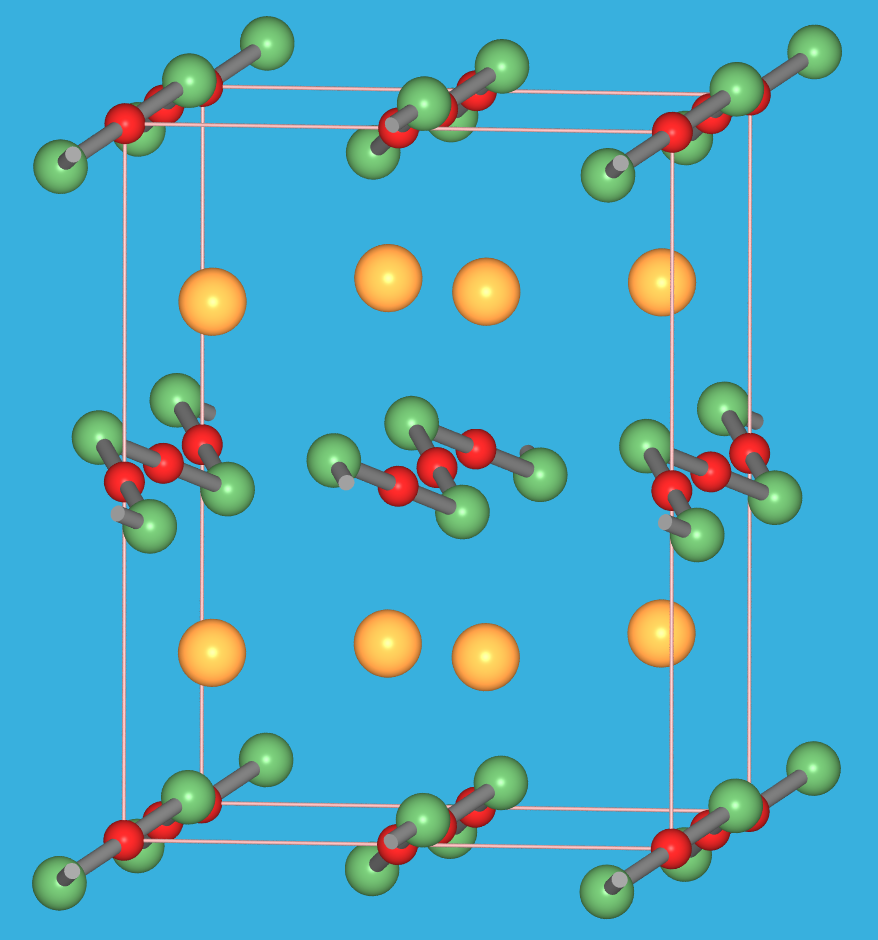
9.2.4. Kristallstruktur des
'unschmelzbaren Präzipitats', HgNH2Cl.
Die Hg-N-Hg-N-Ketten sind am Hg linear, am N gewinkelt zweibindig.
Die H-Atompositionen am N fehlen in der Kristallstrukturbestimmung!!
‣VRML
|
 |
 |
| 9.2.5. Einkristall von
HgI2 (rote Form) (Schenkung von Prof. Dr. W. Schmahl, LMU München)
|
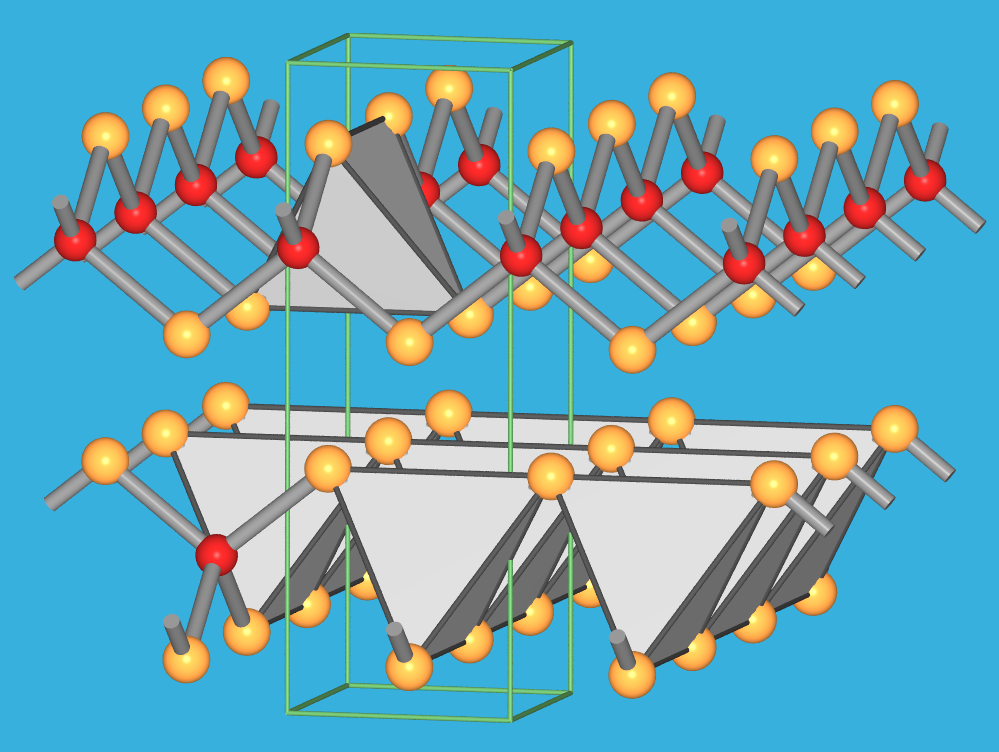
9.2.6. Struktur von
HgI2 (rot) (eigener Typ)
‣VRML
|
Chalkogenide
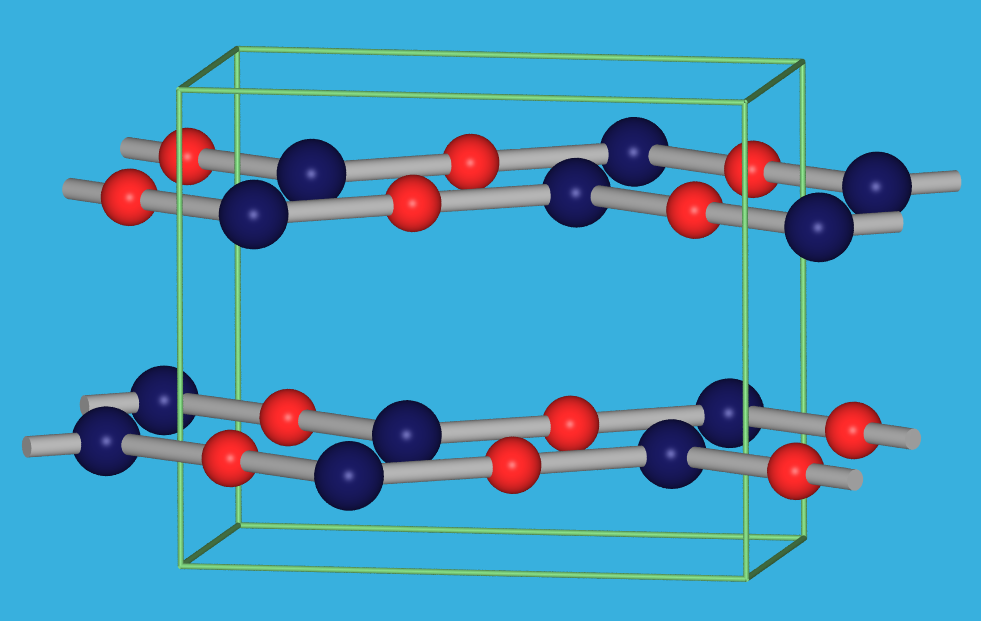
HgO ist dimorph. Beide Modifikationen enthalten Hg in linearer und Sauerstoff in gewinkelter Koordination
(CNHg=CNO=2), d.h. in beiden Formen liegen Ketten -O-Hg-O-Hg- mit Winkelung am Sauerstoff vor.
- Die Struktur der roten, orthorhombischen Form von HgO enthält planare Ketten
(Abb. 9.2.7. links; rot: O; gelb: Hg).
Sie kann aus den Elementen bei ca. 300 oC hergestellt werden und
zerfällt oberhalb von 400oC wieder in die Elemente.
- Die gelbe, trigonale Form von HgO (s. Foto in Abb. 9.2.7.)
kristallisiert isotyp zum Zinnober (rote Form von HgS) und enthält die Ketten in geschraubter Anordnung (Abb. 9.2.7 rechts).
Diese Form entsteht bei der Fällung aus Lösungen.
 |
 |
| rote Form
‣VRML
|
gelbe Form
‣VRML
|
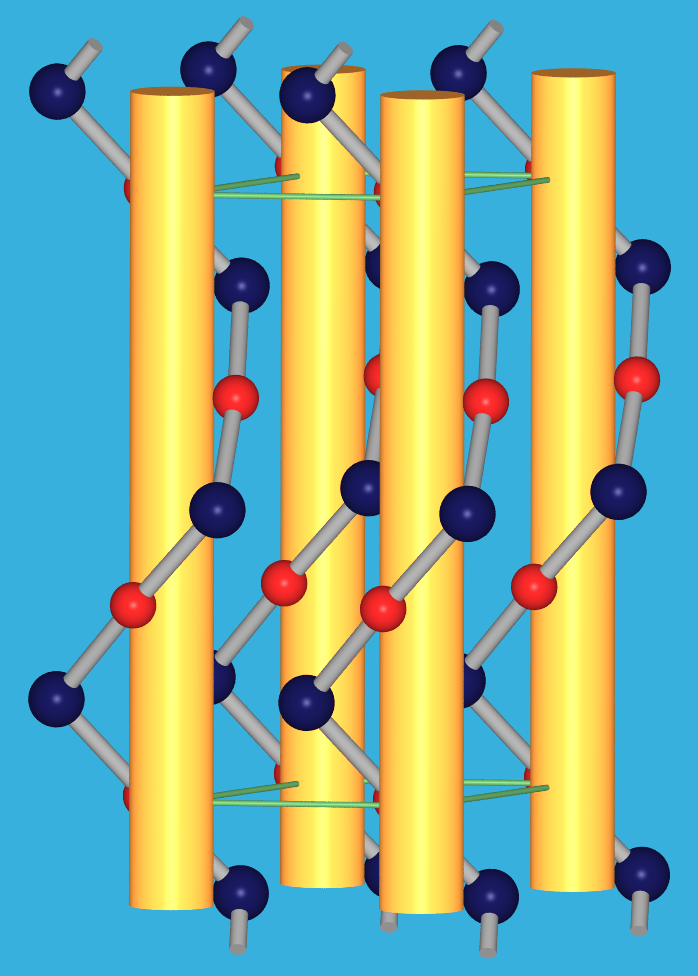
| 9.2.7. Kristallstrukturen
der roten und der gelben Form von HgO (rot: Hg; blau: O)
|
Auch von Quecksilber-Sulfid, HgS, gibt es zwei Modifikationen, die rote Form (Zinnober) ist isotyp zur gelben
Form von HgO, die schwarze Form kristallisiert in der Zinkblende-Struktur. Das Foto in Abbildung 9.2.8. zeigt
links die gelbe Form von HgO, sowie die beiden Modifikationen von HgS. Die Farben resultieren in allen
Fällen aus Band-Band-Übergängen.
 |
| 9.2.8.
Gelbe Form von HgO (links) sowie die beiden Modifikationen von HgS (Mitte und rechts)
|
Die rote Form von HgS, Zinnober, war, wie auch das gelbe Cadmiumsulfid,
früher ein wichtiges brilliantes Rotpigment, das z.B. auch in Farbmalkästen vorhanden war
und vor allem zum Einfärben von Kunststoffen ('Legosteine') verwendet wurde.
Eine tolle Beschreibung alter Pigmente in der Malerei gibt es auf der
Web-Seite von J. Lipscher.













