Vorlesung Chemie der Nichtmetalle
5. Chalkogene: O, S, Se, Te, Po
5.2. Wasserstoffverbindungen
|
Die wichtigsten Verbindungen der Chalkogene mit Wasserstoff sind natürlich die Dihydride, die
von allen Elementen bekannt sind. Darüber hinaus gibt es mit H2O2 und
bei den schwereren Elementen zahlreiche Wasserstoffverbindungen mit E-E-Bindungen (im Fall von E=S die sogenannten
Polysulfane).
5.2.1. Dihydrogenchalkogenide H2X
Die einfachsten Wasserstoffverbindungen der Chalkogene sind die Verbindungen H2E.
In der folgenden Tabelle sind die wichtigsten Eigenschaften dieser Verbindungen zusammengestellt:
| |
H2O |
H2S |
H2Se |
H2Te |
| Sdp. [oC] |
100 |
-61 |
-42 |
-2 |
| Struktur |
gewinkelte Moleküle, H-E-H-Winkel abnehmend |
| Säurestärke |
⟶ zunehmend ⟶ |
| thermische Stabilität |
⟶ abnehmend ⟶ |
| Bildungsenthalpien [kJ/mol] |
-53 |
-4.8 |
+18 |
+34 |
| Oxidierbarkeit |
⟶ zunehmend ⟶ |
| starke Atemgifte |
⟶ zunehmend ⟶ |
| Löslichkeit in H2O |
⟶ abnehmend ⟶ |
Tab. 5.2.1. Eigenschaften der Dihydrogenchalkogenide
Besonders wichtig sind die Unterschiede in den Schmelz- und Siedepunkten, die vor allem
durch die starken Wasserstoffbrückenbindungen im Dihydrogenoxid bedingt sind.
Vorkommen und Gewinnung
- Wasser, H2O
- Schwefelwasserstoff, H2S,
kommt im Erdgas in erheblichen Mengen vor (s. Schwefel-Gewinnung).
Auch Wasser aus Schwefelquellen enthält H2S.
Die Darstellung gelingt am Bimssteinkontakt aus den Elementen
H2 + S ⟶ H2S
oder aus Sulfiden mit verdünnten Säuren, z.B.
FeS + 2 HCl ⟶ FeCl2 + H2S
(z.B. in einem Kippschen Apparat).
- Die Wasserstoffverbindungen der schwereren Homologe, H2Se
und H2Te,
können ebenfalls aus den Metallsalzen erhalten werden:
Al2Se3/Al2Te3 + 6 HCl ⟶ Al2Cl6 + 3 H2Se/H2Te
Eigenschaften
Alle Verbindungen sind schwache zweibasige Säuren.
- H2O ist eine extrem beständige Verbindung.
Sie bildet eine große Zahl strukturell interessanter kristalline Phasen (Eismodifikationen,
s. Kap. 2.2. der Vorlesung Strukturchemie der Oxide).
Die Anomalie des Wassers, die Tatsache das Eis eine geringere Dichte als flüssiges Wasser hat,
ist für das Leben auf der Erde von extremer Bedeutung.
Die charakteristische Neigung der Liquiduslinie, die eine negative Steigung hat, erlaubt
ein Schmelzen unter Druck. Die Details werden in der Physikalischen Chemie
ausführlich besprochen.
- H2S ist ein brennbares, farbloses Gas, das
übel riecht (klassische Stinkbomben! faule Eier!) und ein starkes Nervengift darstellt.
Es verbrennt mit blauer Flamme und ist ein Reduktionsmittel. Ansonsten ist es
aus der Analytik hinlänglich bekannt.
- H2Se und H2Te sind
deutlich endotherme Verbindungen.
Analytischer Nachweis der Anionen
Die Anionen der Säuren (z.B. Sulfid) lassen sich nachweisen:
- durch Fällen als PbS oder CdS.
- Im Sauren durch die Oxidation zu elementarem Schwefel und gleichzeitiger
Reduktion von I2 zu Iodid.
- Im Alkalischen erfolgt hierbei, d.h. unter gleichen Bedingungen, die Reduktion
bis zum Sulfat (SVIO42-).
5.2.2. Andere Wasserstoffverbindungen
Wasserstoffverbindungen mit Element-Elementbindungen sind Wasserstoffperoxid und Polysulfane.
H2O2 (Wasserstoffperoxid)
- H2O2 ist ein gewinkelt aufgebautes Molekül.
Die Bindungswinkel und Abstände im Gas sind in Abb. 5.2.1. genannt.
Im Festkörper beträgt der Winkel H-O-O dagegen 110 o und der
Diederwinkel ist 90 oC.
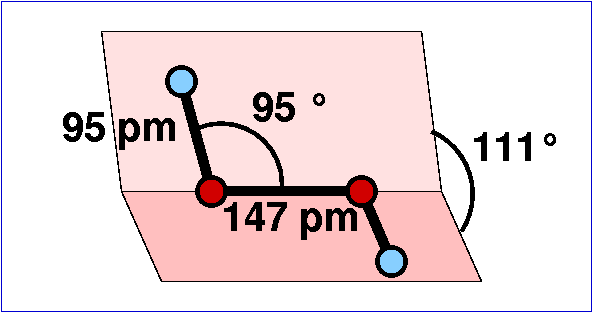
| Abb. 5.2.1. Molekülstruktur von H2O2
‣SVG
|
- Zur Darstellung gibt es verschiedene Wege:
- Es entsteht bei der Hydrolyse von Peroxiden, z.B. von Bariumperoxid:
BaO2 + H2SO4 ⟶ BaSO4 + H2O2
- Wird bei der Elektrolyse von H2SO4 eine extrem hohe Spannung angelegt, dann
wird Peroxodischwefelsäure gebildet, die bei der Hyrolyse H2O2 abgibt:
HO3S-O-O-SO3H + 2 H2O ⟶ H2O2 + 2 H2SO4
- Zur technische Darstellung wird ein Kreisprozess mit Pd-Kontakt gefahren, der auf der
Reduktion von Anthrachinon zu Hydrochinon basiert; im Folgeschritt wird mit Luftsauerstoff wieder
Anthrachinon und H2O2 gebildet:
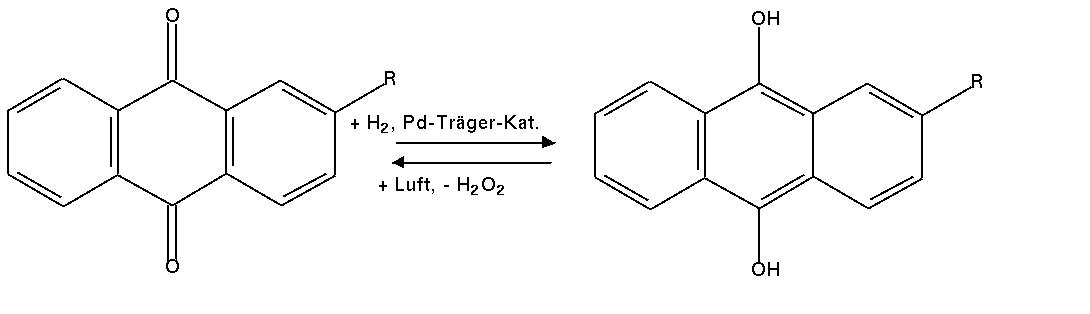
| Abb. 5.2.2. Technische Herstellung von H2O2
‣SVG
|
- Eigenschaften:
- Wasserstoffperoxid ist eine sirupöse Flüssigkeit mit einem Siedepunkt von 150 oC.
- Es ist nur metastabil und zerfällt z.B. bei Anwesenheit von
Spuren von Schwermetallen gemäß:
H2O2 ⟶ H2O + 1/2 O2 (-98 kJ/mol)
- H2O2 ist eine schwache Säure mit einem pKs-Wert von 12.
- Es hat primär oxidierende Wirkung:
H2O2 + 2 H3O+ + 2 e-
⟶ 4 H2O (E0=+1.78)
- Reduzierende Wirkung zeigt Wasserstoffperoxid nur gegen starke Oxidationsmittel
wie z.B. MnO4-, PbO2 oder O3:
H2O2 + 2 H2O ⟶
O2 + 2 H3O+ + 2e- (E0=+0.68V)
- Wasserstoffperoxid bildet 'Additions'verbindungen mit Salzen
wie z.B. Peroxohydrate, z.B. K2CO3 . 2 H2O2.
Bekannt ist auch das in Waschmitteln als Bleichmittel verwendete Perborat (ACHTUNG, dieser Name ist nicht sinnvoll!),
formal NaBO2.H2O2. 3 H2O
oder kurz NaBO2(OH)2.3 H2O mit der in Abbildung 5.2.3. wiedergegebenen
Struktur.
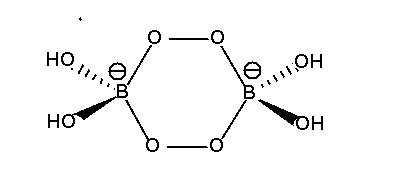
| Abb. 5.2.3. Das Anion von 'Perborat'
‣SVG
|
- Wasserstoffperoxid wird in Mengen von ca. 1/2 Millionen Tonnen pro Jahr hergestellt und
findet Verwendung:
- als Bleichmittel.
- für organische Peroxo-Chemikalien.
- als Haarfärbemittel, Lebensmittelzusatz, Desinfektionsmittel.
- zur Herstellung von Epoxiden usw...
- Der analytische Nachweis des Anions ist möglich mit den
Peroxokomplexen von Ti(VI), [TiO2]SO4 (orangerot) oder
von Chrom(VI) (Chromperoxid, CrO5, tiefblau).
H2Sx (Sulfane)
Unter den Sulfanen H2Sx sind die Verbindungen mit x=2-8 bislang
isoliert und charakterisiert. Sie sind flüssig bis wachsartig, die Färbung nimmt
mit der Kettenlänge zu. Die Moleküle sind unverzweigte Ketten, deren Enden mit
Wasserstoff abgesättigt sind. Sie lassen sich aus Polysulfiden erhalten:
Na2Sx + 2 HCl ⟶ 2 NaCl + H2Sx
und durch Rektifikation bei vermindertem Druck voneinander trennen.
Die Sulfane sind instabil gegen die Disproportionierung nach
H2Sx ⟶ H2S + n-18 S8
Da die Halogen-Sauerstoffverbindungen bereits bei den Halogenen besprochen wurden,
soll im folgenden nur noch auf die Halogen-Verbindungen der schwereren Chalkogene
Schwefel, Selen und Tellur eingegangen werden.


