Vorlesung Chemie der Metalle
7.Lanthanoide und Actinoide
7.1 Lanthanoide
Während die Lanthanoide früher lediglich als einfache und billige Reduktionsmittel
oder als 'Zündsteine' eingesetzt wurden, steigt
die praktisch-technische Bedeutung dieser Elemente z.B. für den Einsatz in
Magnet-, Laser- oder Lumineszenz-Materialien (und damit auch deren Wert!) stetig.
Diese zunehmende Bedeutung war auch der Grund, dass es im WS 21/22 eine komplette
Vorlesung zum Thema Seltene Erden/Lanthanoide gab. Auf den entsprechenden Web-Seiten gibt es die
PDF-Dateien zu allen Stunden, insbesondere interessant die Kapitel
zu Lumineszenz- und zu
metallischen Magnet-Materialien.
Die chemischen und physikalischen Eigenschaften der Lanthanoid-Elemente, das sind im Einzelnen ...
| Ceriterden |
| Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
| (Cer) |
(Praseodym) |
(Neodym) |
(Promethium) |
(Samarium) |
(Europium) |
(Gadolinium) |
| Yttererden |
| Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
| (Terbium) |
(Dysprosium) |
(Holmium) |
(Erbium) |
(Thulium) |
(Ytterbium) |
(Luthetium) |
verlaufen im Periodensystem teils kontinuierlich, teils diskontinuierlich. Die Gründe liegen in den
elektronischen Verhältnissen:
- Kontinuierliche Verläufe:
Innerhalb der Gruppe der Lanthanoide werden die 4f-Zustände
(s. Orbitale) besetzt.
Da die f-Niveaus nicht ausgedehnt sind, ist die Zahl der f-Elektronen für die
Chemie (nicht die Physik!) der Elemente praktisch ohne Bedeutung. Beispielsweise bilden
alle Lanthanoide dreiwertige Ionen Ln3+, wie sie auch bereits beim Lanthan
selber vorliegen. Die Besetzung der f-Zustände hat damit nur Auswirkungen
kontinuierlicher Art. Am wichtigsten ist hierbei die sogenannte
Lanthanoidenkontraktion, die kontinuierliche Abnahme der Ionen- (z.B. für Ln3+)
und Atomradien. So beträgt der Ionenradius von La3+ 116 pm
und nimmt bis zum Luthetium auf 98 pm ab. Der Grund hierfür ist
die Tatsache, dass die erhöhte Ordnungszahl, d.h. steigende Kernladung
durch die weit innen liegenden f-Elektronen
(s. Abb. der radialen Dichten) schlechter abgeschirmt werden. Damit
steigt die effektive Kernladungszahl Zeff und die Radien fallen.
Auch der Einfluß relativistischer Effekte wird hier diskutiert.
Die Lanthanoidenkontraktion hat auch Auswirkungen auf die nachfolgenden Elemente
und bewirkt z.B. die große chemische Ähnlichkeit von Zirkon und Hafnium, von Niob und Tantal
und auch noch von Molybdän und Wolfram.
- Diskontinuierliche Verläufe: Aufgrund der jeweils etwas
stabileren Elektronenkonfigurationen f0 (alle f-Zustände unbesetzt),
f7
(alle f-Zustände halbbesetzt) und f14 (vollständig gefüllte f-Zustände)
lassen sich die Elemente in zwei Gruppen teilen:
- Als Ceriterden bezeichnet man die ersten sieben Elemente mit Elektronenkonfigurationen
von f0 bis f7.
- Die Yttererden haben Elektronenkonfigurationen zwischen
f8 und f14.
Schreibt man die beiden Elementgruppen wie oben untereinander, so ergeben sich
für untereinander stehende Elemente auch Gemeinsamkeiten (Lochformalismus, s.u.).
So bilden z.B. die jeweils mittleren Elemente farbige Ionen. Am Anfang jeder
Gruppe gibt es zusätzlich zu den drei- auch vier-wertige, am
Ende auch zweiwertige Ionen.
Die Eigenschaftsänderungen sind schematisch in der folgenden Übersicht (Abb. 7.1.1.) zusammengestellt:
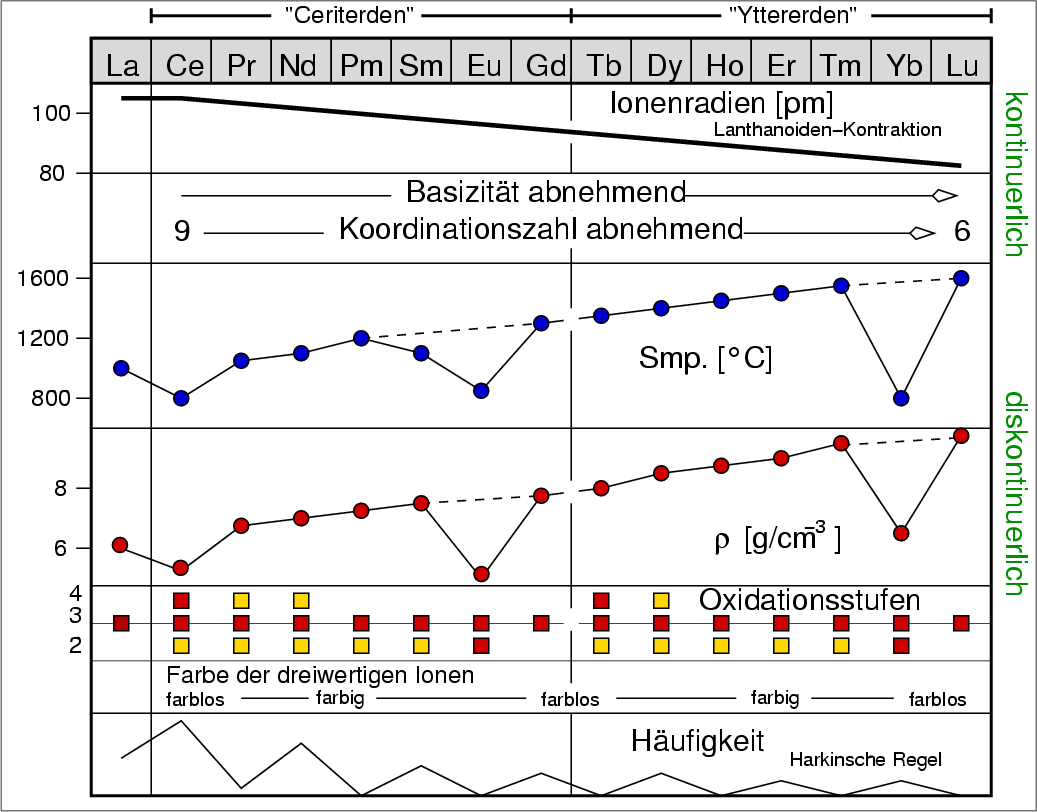
Abb. 7.1.1. Übersicht zu Eigenschaften und Chemie der Lanthanoide
‣SVG
- Kontinuierliche Verläufe:
- Atom- und Ionenradien nehmen kontinuierlich ab (Lanthanoidenkontraktion).
- Damit nimmt auch die Koordinationszahl der dreiwertigen Ionen in Verbindungen ab (z.B. A/B/C-Struktur der Oxide).
- Bedingt hierdurch ist auch die Abnahme der Basizität der Oxide und Hydroxide von links nach
rechts (vgl. z.B. Ba-Ca).
- Diskontinuierliche Verläufe:
- Schmelzpunkt (und Siedepunkte) zeigen Minima bei Europium und Ytterbium.
- Die Dichte der Elemente hat ebenfalls Minima bei Europium und Ytterbium, die
metallischen Radien haben umgekehrt Maxima bei diesen beiden Elementen.
- Oxidationsstufen und Elektronen-Konfiguration
(Bei den Kationen sind diejenigen Elektronen, die abgegeben werden farblich gekennzeichnet.)
- Die freien Atome (OS = 0) haben (mit der Ausnahme von Ce, Gd und Lu)
die Elektronenkonfigurationen
6s25d04fn+1,
d.h. die d-Schale ist komplett leer und die f-Schale mit einem Elektronen mehr
als der Stellung im PSE entspricht besetzt.
- Die Oxidationsstufe +3 ist für alle Lanthanoide bekannt.
Die Elektronenkonfiguration ist hier 6s2
5d14fn, die farblich markierten
Elektronen werden abgegeben, so dass die
Kationen eine 4fn-Elektronenkonfiguration haben.
- Die Oxidationsstufe +4 tritt nur bei den jeweils ersten Elementen der beiden Gruppen
auf, d.h. bei den Cerit-Erden Cer (Ce), Praseodym (Pr) und Neodym (Nd) und bei den Yttererden Terbium (Tb) und Dysprosium (Dy).
Die Grundelektronenkonfiguration ist hier
6s2 5d2
4fn-1,
die violett markierten Elektronen werden wieder abgegeben und die Kationen weisen eine
4fn-1-Elektronenkonfiguration auf. Die Stabilität von Ce4+
folgt damit sofort aus der Edelgaskonfiguration, die von Tb4+ aus der
halb besetzten f-Schale (6s0 5d04f7).
- Die Ionen der Ladung +2 sind nur bei den jeweils vorletzten Elementen der beiden Gruppen
stabil (6s25d04fn+1)
und zwar bei den Cerit-Erden Europium (Eu) (und Samarium, Sm) und bei den Yttererden
Ytterbium (Yb) (und Thulium, Tm).
Die Kationen haben dann 4fn+1-Konfiguration. Yb2+ (das 13. Element) hat damit
eine vollständig gefüllte f-Schale, Eu2+ (das 6. Element) wieder die
f7-Halbbesetzung.
- Farbe der Ionen Ln3+
In der Mitte der beider Gruppen sind die Ionen
als Folge von f⟶f-Übergängen (vgl. den d-d-Übergängen bei den Übergangsmetall-Ionen)
farbig (meist rot-violette, blasse Farben). Beispielsweise ist Er2O3
blass erdbeerfarben (Abb. 7.1.2.),
PrIII(NO3)3 . 5 H2O und PrIII2O3
(s. Abb. 7.1.18) sind grün.
Ho2O3 erscheint im künstlichen Licht rosa, im
Sonnenlicht sieht es gelb aus (s. Video unten).
Die optischen Eigenschaften sind für Anwendungen der Lanthanoide (Fluoreszenz, Laser)
extrem wichtig (s.u.).
 |
 |
 |
| Abb. 7.1.2. Er2O3 |
Abb. 7.1.3. Nd2O3 |
Abb. 7.1.4 Lösungen der Lanthanoide: oben Didymchlorid;
Mitte: Neodym-Nitrat; unten: Praseodym-Chlorid |
Vorkommen (‣SVG zu Elementhäufigkeiten in der Erdkruste)
Die Lanthanoide kommen in zwei wichtigen Mineralklassen
vor. Die Häufigkeit folgt (wie bei allen Elementen) der sogenannten
Harkin'schen Regel, nach der Elemente mit geraden Kernladungszahlen häufiger sind.
Wegen der chemischen Ähnlichkeit ist dieser Gang besonders deutlich zu
verfolgen.
Das Vorkommen ist in den beiden Gruppen unterschiedlich:
- Die Ceriterden enthalten Lanthan und die leichteren Lanthanoide. Die wichtigsten Minerale sind:
- Die Yttererden enthalten die schwereren Lanthanoide und Yttrium. Einige wichtige Minerale sind:
- Thortveitit: (Y,Sc)2Si2O7
(ein Disilicat)
- Xenotim: YPO4
(da rHo3+ etwa vergleichbar mit
rY3+
(Foto Mineral ).


|
 |
| Abb. 7.1.5. Bastnäsit (o: kleiner Kristall, ca. 1 cm, u: Erz) |
Abb. 7.1.6. Schaukasten 'Lanthanoide' |
Die Namen von vier der Elemente sind vom Namen des Fundortes Ytterby in der Nähe von Stockholm
abgeleitet: Ytterbium, Yttrium, Erbium und Terbium.
Auch Holmium (für
Stockholm) und Thulium (sowie die Elementnamen Scandium und Yttrium) gehen auf diesen Fundort zurück.
In Abbildung 7.1.7. ist als Beispiel für die in Ytterby vorkommenden Minerale
ein Gadolinit (auch Ytterbit genannt, Fundstück von 2024 direkt aus Ytterby !!) gezeigt. Es handelt sich um ein Be-Inselsilicat
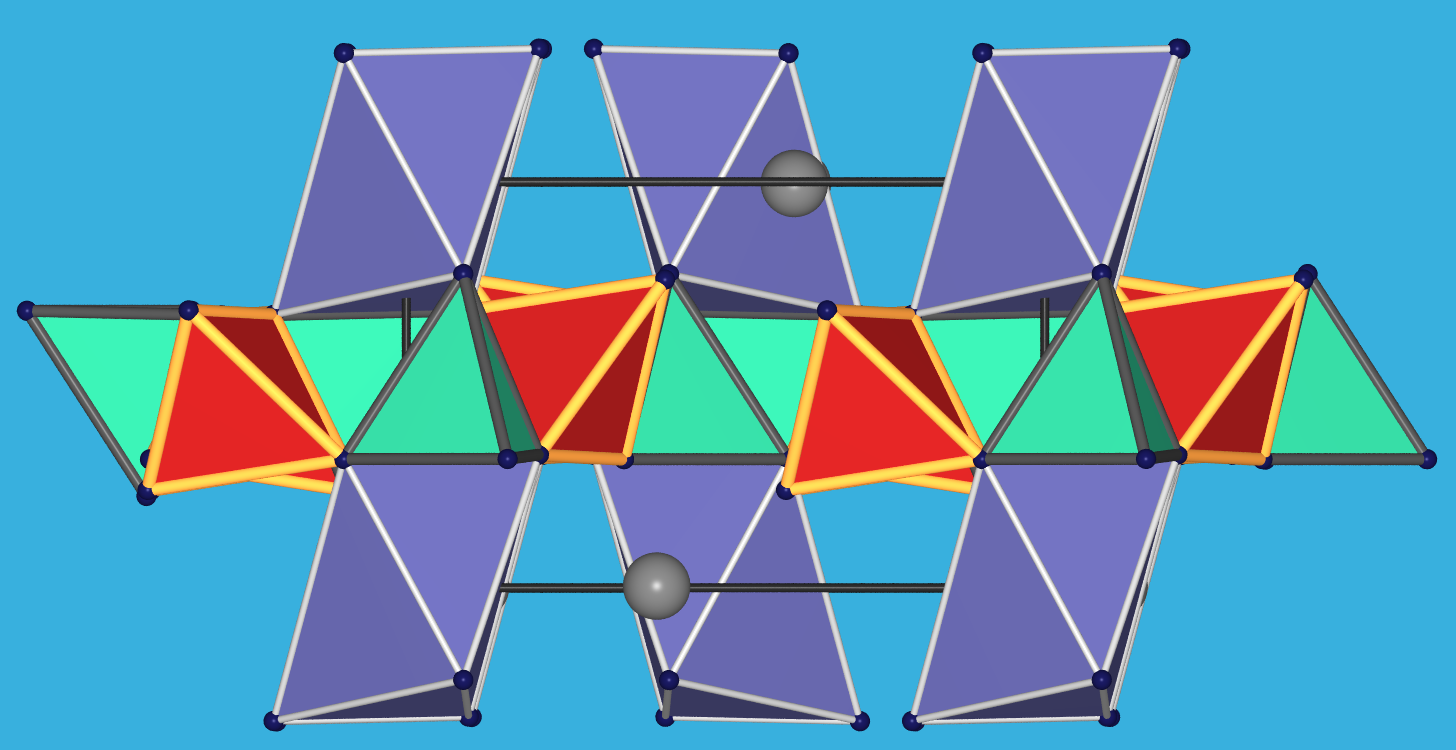
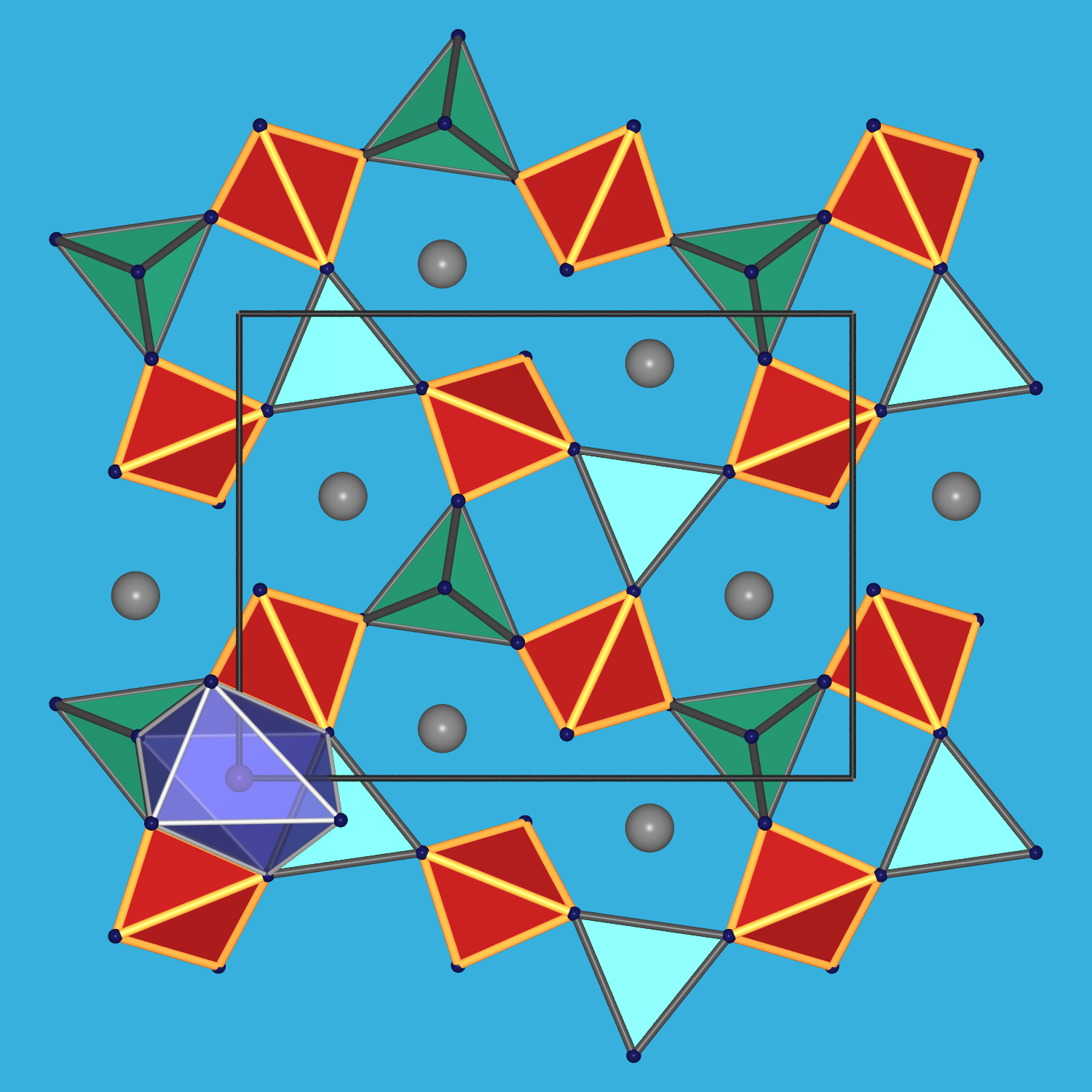
der allgemeinen Summenformel Ce2FeIIBe2O2[SiO4]2.
[BeO4]- und [SiO4]-Tetraeder bilden gemäß
[BeO3/2O][Si3/2O] = [BeSiO5] = [Be2Si2O10] eine Schicht
mit Vier- und Achtringen aus. Die Fe(II)-Ionen sind oktaedrisch koordiniert, Ce (Cd,Y,La) etc. haben eine Achter-Koordination
durch Oxid-Ionen.

|
|
Abb. 7.1.7. Gadolinit
(Ce2FeIIBe2O2[SiO4]2)
Links: Fundstück aus der Grube Ytterby/Schweden [Spende von Sonja Wursthorn, Tobias Dörr und Finn Sobanja. Danke! :-)]
Rechts: die monokline Kristallstruktur betrachtet entlang der kurzen a-Achse (oben) sowie Aufsicht auf die
Be/Si-Schichten (unten; [Si/BeO4]-Tetraeder: rot/grün; [FeO6]-Oktaeder: violett; Ce: graue Kugeln)
‣VRML
|
Darstellung und Trennung
Vor der Gewinnung und Trennung der Elemente werden Flotationen zur Anreicherung der
Seltenerd-Minerale vorgeschaltet. Dazu müssen die Rohstoffe fein aufgemahlen werden.
Die flotierten Erze werden dann
bei 150 oC mit 50%iger NaOH behandelt. Hierbei fallen die Hydroxide Ln(OH)3
als schwerlösliche Niederschläge aus, die anschliessend in HNO3
wieder gelöst werden.
Das Hauptproblem bei der Gewinnung der Lanthanoide ist deren Trennung.
(Die Elemente wie Eu, Yb und Ce, die in verschiedenen Oxidationsstufen stabil sind, lassen
sich selbstverständlich chemisch zunächst leicht abtrennen. Mit Hilfe von elementarem Zink
kann Europium reduziert werden und dann als schwerlösliches EuSO4 (s. Analogie zu
den Erdalkalimetallen) abgetrennt werden. Cer kann mit Wasserstoffperoxid oxidiert und dann
als Oxid gefällt werden.)
Für die Trennung der ausschliesslich dreiwertigen Lanthanoide können
verschiedene Unterschiede der Kationen ausgenutzt werden:
- Die Unterschiede in der Löslichkeit wurden bei den heute veralteten Verfahren wie
der fraktionierten Kristallisation der Salze 2 Ln(NO)3 3 Mg(NO3)2
oder der fraktionierten Fällung der Hydroxide Ln(OH)3 ausgenutzt.
- Die Variation der Basizität kann für die fraktionierte Zersetzung der Nitrate
ausgenutzt werden. Auch dies ist ein historisches Verfahren.
- Die unterschiedliche Tendenz zur Komplexbildung wird
heute z.B. bei der Solventextraktion mit Tributylphosphat (TBP=(nbu-O)3PO),
bei der es zur Bildung von Neutralkomplexen Ln(NO3)3(TBP)3 kommt, ausgenutzt.
Die Solventextraktion erfordert mehrere hundert einzelne Trennungen
und wird in sog. Mischer-Scheider-Batterien (s. Abb. 7.1.8.) im Gegenstrom durchgeführt.
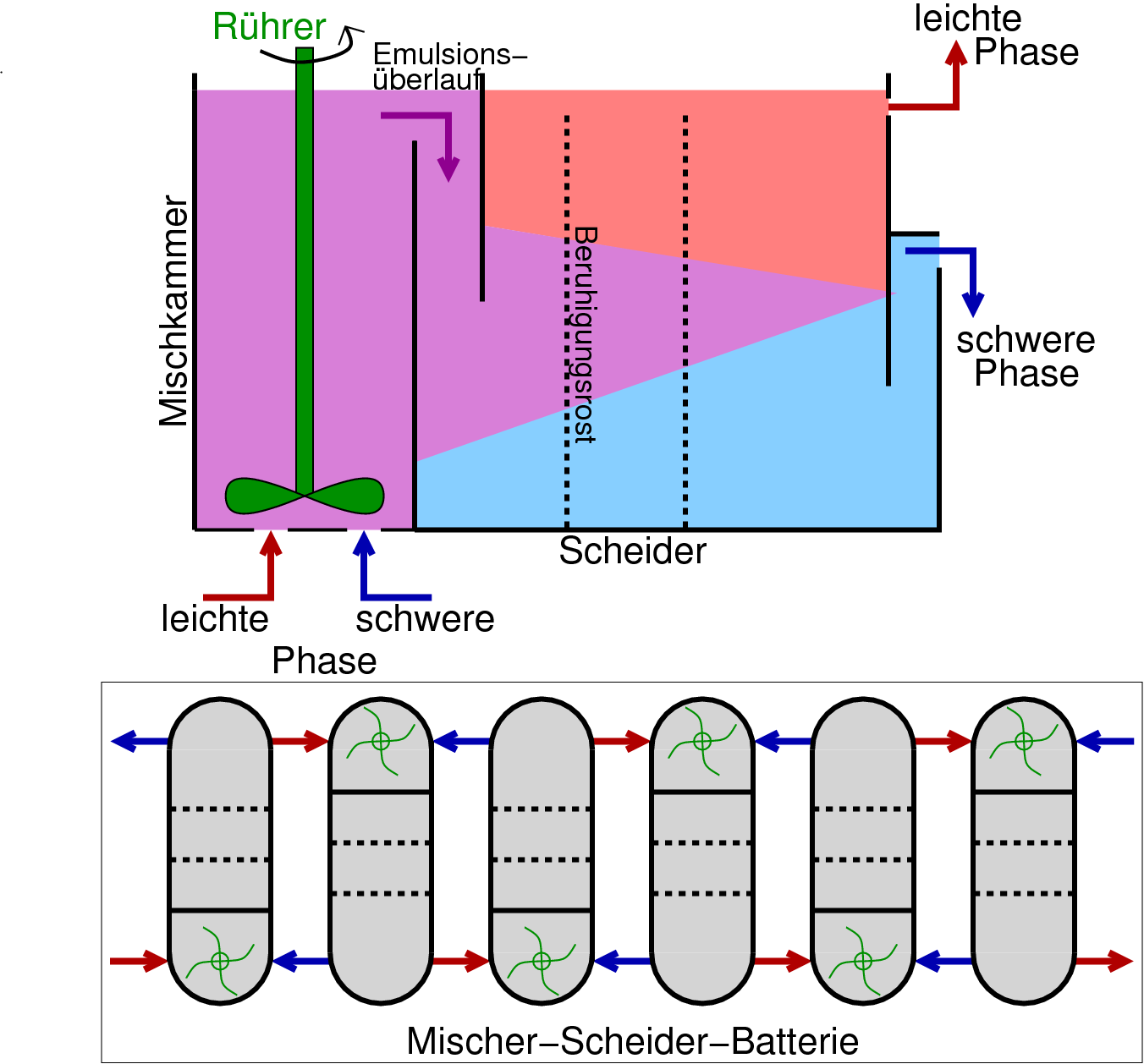
Abb. 7.1.8. Mischer-Scheider-Zelle und Batterie-Verschaltung (Gegenstromprinzip!)
‣SVG
Die Solventextraktion ist heute das wichtigste Verfahren zur Trennung der Lanthanoide,
da es sich um ein kontinuierliches Verfahren mit hohen Durchsätzen handelt.
- Der Ionenaustausch, kombiniert mit Komplexbildung, ist (da diskontinuierlich)
eine reine Labormethode zur Trennung der Elemente:
Auf organischen Austauschersäulen (z.B. auf Ammonium-Polystyrol-Sulfonat)
verbleiben die verschiedenen Lanthanoid-Ionen an unterschiedlichen Stellen der Säule
(normalerweise La3+ oben und Lu3+ unten).
Zur Elution wird dann ein Komplexbildnern (z.B. EDTA) genutzt, der mit den unten in
der Säule befindlichen Element-Ionen stabilere Komplexe bildet, so dass nochmals eine
Trennung (auf Basis Komplexbildungskonstanten) erreicht wird.
Zur Gewinnung der reinen Elemente werden dann
- die Fluoride mit Calcium oder
- die Chloride elektrolytisch
reduziert.
Die Weltjahresproduktion an Lanthanoiden beträgt insgesamt ca. 240 000 t (2021).
Der Weltmarkt ist in starker Bewegung und derzeit lange nicht mehr so deutlich wie noch 2010/2011 durch
chinesische Anteile (2011: 98 %, 2020: ca. 70 %) geprägt. Die Preise für seltene Erden
waren in den Jahren 2010/2011 extrem hoch, in den letzten Jahren sind sie wieder deutlich gefallen, da
inzwischen Minen in Australien, Kanada, Malaysia und USA aktiv sind.
Aktuell das wertvollste Element ist Terbium mit einem Kilogrammpreis von 1000 Dolar für das Oxid.
Cerdioxid kostet dagegen nur ca. 1 Dollar/kg.
s. interessante externe Links hierzu:
Die Elemente sind silberweiße, relativ weiche (Ce z.B. wie Sn, Fotos von Er und Yb s. Abb.
7.1.9.)
Metalle, die an der Luft (z.T. erst bei Erhitzen) selbstentzündlich sind.
Sie sind kräftige Reduktionsmittel, die Normalpotentiale liegen mit ca. -2 V im Bereich
des Magnesiums.
Die Schmelzpunkte liegen zwischen 900 und 1600 oC, mit
den besprochenen Minima bei Eu und Yb.
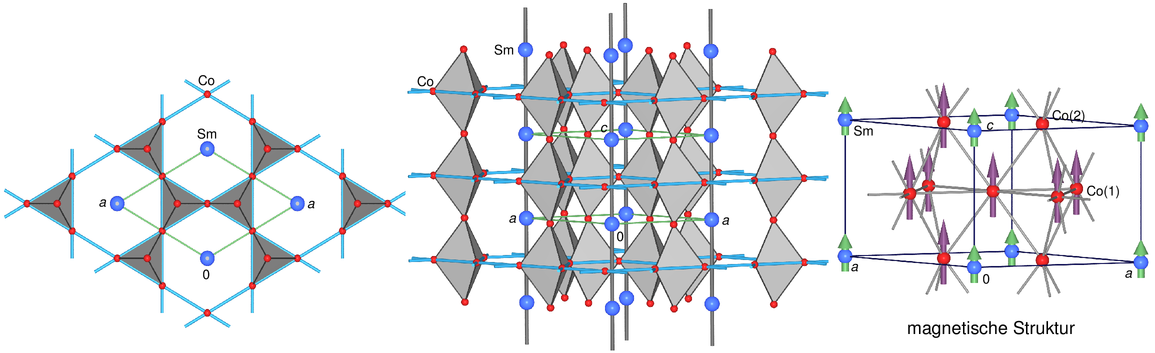
Die Elemente Gd, Dy, Ho und Er werden bei tiefen Temperaturen (flüssigem Stickstoff)
ferromagnetisch. Bis auf Eu, das eine b.c.c.-Struktur aufweist, liegen
verschiedene dichte Packungen (h.c.p., f.c.c. und auch andere Stapelvarianten) vor.
 |
 |
 |
| Abb. 7.1.9. Die Elemente Erbium (links, 2x!) und Ytterbium (rechts) |
Überblick über Chemie und Verbindungen
Die Lanthanoide bilden schwerlösliche Hydroxide, Phosphate, Carbonate und Fluoride.
Die wichtigste Oxidationsstufe ist +3.
Es gibt damit einige Analogien zum Aluminium, da die Elemente aber
deutlich elektropositiver sind als Aluminium (E0 ca. -2.3 V) gibt es auch
weitreichende Ähnlichkeiten mit den Erdalkalimetallen wie z.B. Barium.
Die typischen Koordinationszahlen gegen Sauerstoff z.B. in Hydraten, Oxiden
oder auch Komplexen sind 8 bis 9, nach unten ist bis 6 möglich (bei den späten Lanthanoiden).
Die einzelnen Verbindungsklassen:
- Die Halogenide sind je nach Oxidationsstufen
Di-, Tri- und Tetra-Halogenide. Von den drei- und vierwertigen Ionen sind auch Komplexe
wie z.B. in A+3[LnX6] bekannt. Daneben gibt es eine
große Zahl kompliziert aufgebauter gemischtvalenter Halogenide der seltenen Erden.
- Oxide sind ebenfalls in den Oxidationsstufen +2, +3 und +4 bekannt:
- Die LnO mit zweiwertigem Lanthanoid-Kation kristallisieren in der
NaCl-Struktur. SmO ist beispielsweise ein elektronischer Leiter gemäß der
Formulierung als Ln3+(O2-)e-.
- Die Verbindungen Ln2O3 sind für alle Lanthanoide bekannt. Je nach
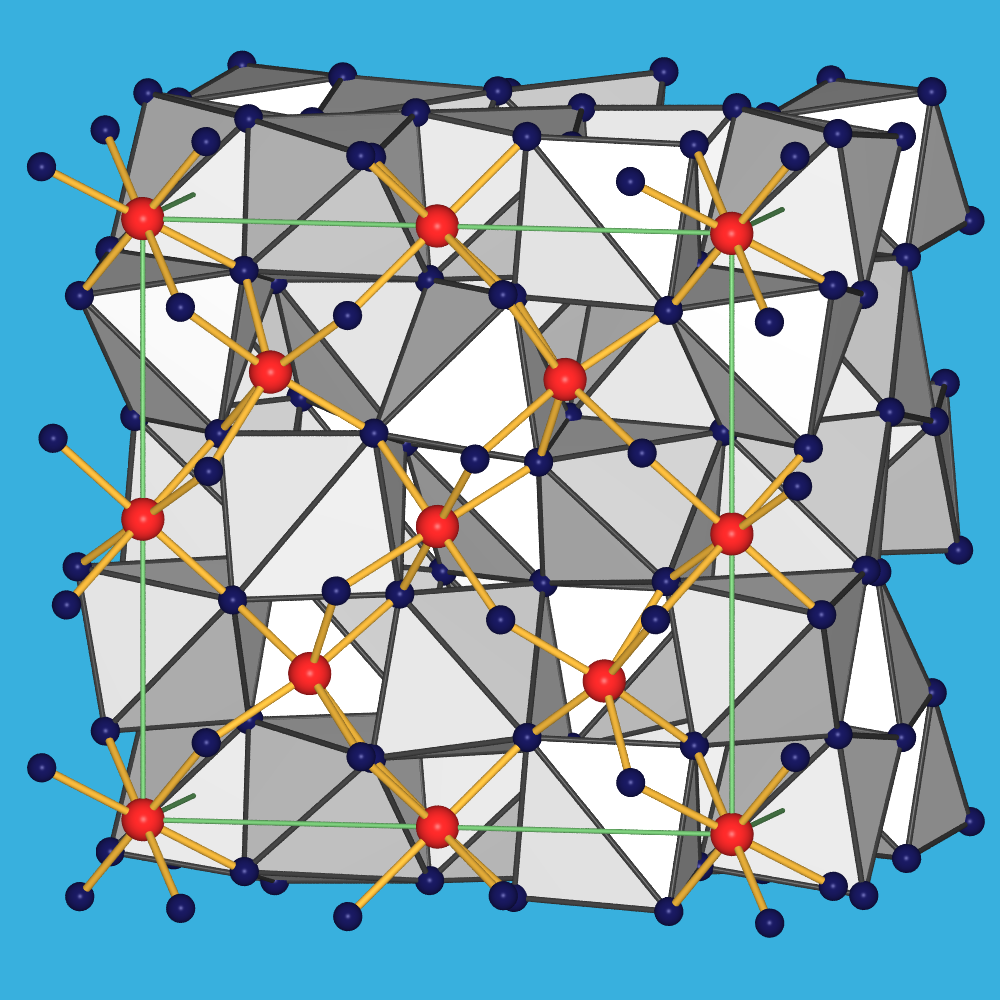
Kationengröße kristallisieren sie in drei Strukturtypen:
- Die leichten, großen Lanthanoide bilden die A-Struktur.
Das Kation liegt hier in Koordinationszahl 7, in Form einer
überkappt oktaedrischen Koordination, vor (Abb. 7.1.10 links).
- Die mittleren Seltenen Erden kristallisieren in der B-Struktur,
mit Ln3+ ebenfalls in CN 7
(überkappt trigonal-prismatisch und überkappt oktaedrisch).
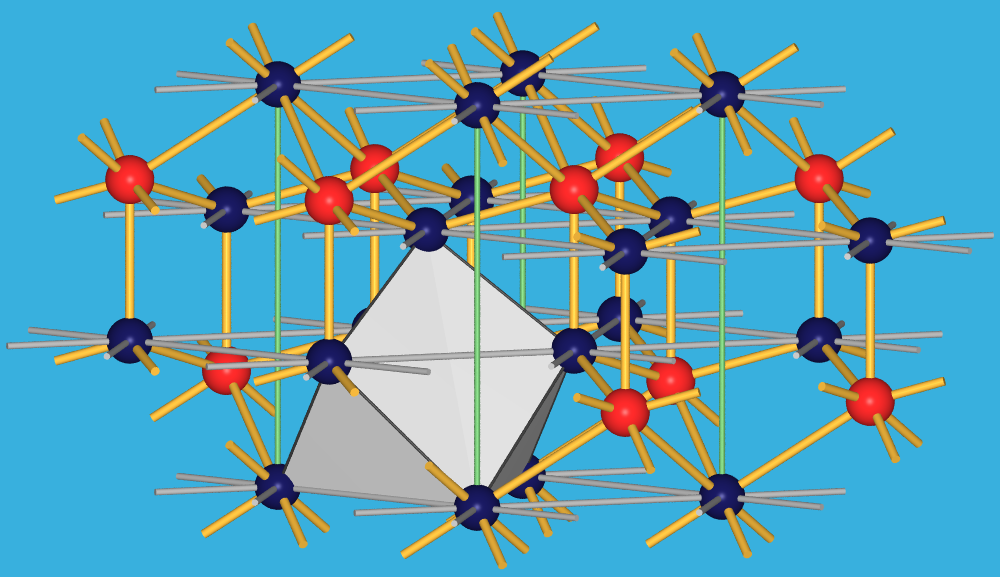
- Die schweren, kleineren Lanthanoide bilden die C-Struktur-Struktur (auch Bixbyit-Typ),
die als Defekt-Fluorit mit CNLn=6 beschrieben werden kann.
Die Oktaeder sind hier über Kanten und Ecken verknüpft (Abb. 7.1.10 rechts).
|
|
|
A-Struktur (z.B. von La2O3)
(hexagonal dichte Kugelpackung mit stark verkleinertem c:a-Verhältnis, La-Kationen
in den aufgeweiteten Oktaederlücken)
‣VRML
|
C-Struktur (Bixbyit; z.B. von Lu2O3)
(kubisch, Raumgruppe Ia3)
‣VRML
|
Abb. 7.1.10. Kristallstrukturen der Ln-Oxide mit A- und C-Struktur
(Ln: rote Kugeln, in grauen Koordinationspolyedern; O: dunkelblaue Kugeln)
- Die Oxide LnO2 kristallisieren meist im Defekt-CaF2-Typ.
- Daneben gibt es auch wieder viele gemischtvalente Oxide.
- Die Lanthanoid-Kationen bilden auch Komplexe mit
relativ hohen Koordinationszahlen von 8 bis 9, wobei - im
Unterschied zu den Nebengruppen (Nebenvalenzen) -
keine Beteiligung von f-Zuständen an der Bindung erfolgt.
Bekannt sind z.B. die Chelatkomplexe mit Nitrat wie
[CeIV(NO3)6]2- mit ikosaedrischer
Koordination (CN=12). Auch der für die Extraktion genutzte TBP-Nitrato-Komplex
ist vergleichbar und typisch.
Besonderheiten von Ce: Ce(IV) und das Redox-System Ce(III)-Ce(IV)
Aufgrund der Elektronen-Konfiguration ist Cer sowohl 3-wertig (6s05d04f1)
(wie die anderen Lanthanoide) als auch 4-wertig (6s05d04f0)
stabil.
- Viele Verbindungen von Ce4+ sind (je nach Ligand/Bindungspartner)
gelb bis gelbbraun.
Die Farbe ist intensiv und resultiert aus Metall-Reduktion-Banden (z.B. vor allem bei O-Liganden;
vgl. das d0-System in Permanganat).
- Reines CeO2 ist dagegen fast weiss (Abb. 7.1.11.) und sehr hochschmelzend.
 |
| Abb. 7.1.11. CeO2 |
Das Oxid CeOx mit x nahe 2 kristallisiert in der CaF2-Struktur.
Für x kleiner 2 liegen Fehlstellen im Sauerstoff-Teilgitter vor, die entsprechend auch
bei vielen anderen Seltenerdoxiden auftreten.
- Ce3+ kann im basischen mit Peroxid-Ionen zu Ce4+ oxidiert werden.
Dabei entsteht in Natronlauge ein rotbrauner Niederschlag von Ce(IV)-Peroxid-Hydraten, deren genaue
Zusammensetzung nicht angegeben werden kann. Auch das beim Erwärmen daraus gebildete
gelbe Hydroxid, Ce(OH)4, ist strukturell unbekannt (Nano-Schlubber).
| ⚗ Oxidation von Ce3+ mit H2O2
(12MB|MP4|H264) |
|
- Analog bildet Cer gemäß
2 Ce3++ 3 H2O2 + 2 OH- ⟶ 2 [CeO2]2+ + 4 H2O
in ammoniakalischer H2O2-Lösung ein Peroxido-Kation (vgl Titan!),
das sich in der Hitze wieder zersetzt:
[CeO2]2+ + 2 OH- + H2O ⟶ Ce(OH)4 + 1/2 O2.
- In der analytischen Chemie kann die Redoxreaktion
Ce3+ ⟶ Ce4+ + e-
bei der sogenannten Cerimetrie ausgenutzt werden, da Ce4+ ein
ähnlich starkes Oxidationsmittel wie Permanganat ist. Im Unterschied zur
Manganometrie ist eine Selbstindikation wegen der nur blassgelben Farbe
i.A. nicht möglich, es muss zusätzlich ein Redoxindikator verwendet werden.
- Die Redoxreaktion zwischen Ce3+ und Ce4+ ist auch an der
berühmtesten oszillierenden Reaktion, der Belousov-Zhabotinsky-Reaktion
beteiligt. Wenn man dabei kein weiteres Redoxsystem einsetzt,
beobachtet man nur einen schwachen Farbwechsel von gelb nach farblos. Unser Versuch
zeigt die hübschere Variante mit Ferroin/Ferriin als weiterem Redoxindikator.
| ⚗ Belousov-Zhabotinsky-Reaktion
(!!!88MB|MP4|H264) |
|
Mit dem Redoxsystem Ce3+/4+ läßt sich eine
oszillierende Reaktion (Belousov-Zhsabotinsky-Reaktion) durchführen
(hier mit dem doppelten Redox-System Cer und Ferroin/Ferriin: SVG;
Das Prinzip ist ein durch die Bromid-Ionen-Konzentration gesteuertes Redoxgleichgewicht,
die insgesamt durch die Bromierung von Malonsäure getrieben wird (s. Reaktionsgleichungen).
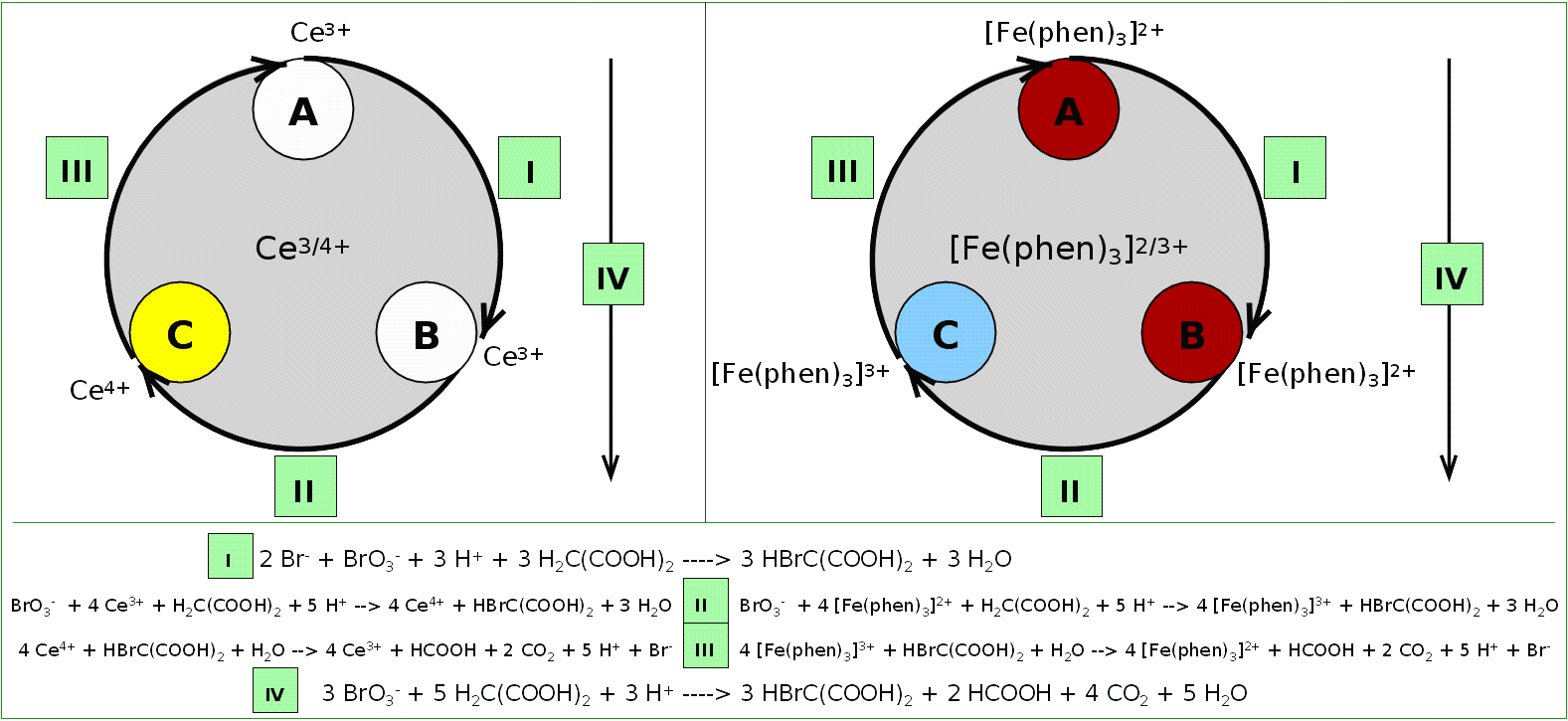
Prinzip und Reaktionsgleichungen der Belusov-Tsabotinsky-Reaktion
mit dem doppelten Redoxsystem von Cer und Ferroin
‣SVG
|
- Es besteht eine gewisse Analogie in den chemischen Eigenschaften von Ce(IV) zur
Chemie der Element-Kationen von Zr und Th.
- Ce(IO4)4 ist eine in der Analytik wichtige schwerlösliche Verbindung.
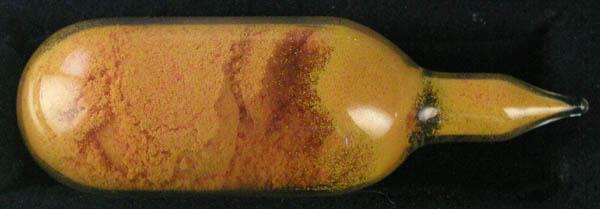
- Das Komplex-Salz (NH4)2[CeIV(NO3)6] (s. Abb. 7.1.12.)
ist eine relativ stabile Ce(IV)-Verbindung.
Es enthält den Hexanitrato-Komplex mit ikosaedrischer
Koordination, dessen Struktur in Abb. 7.1.12. gezeigt ist.
 |
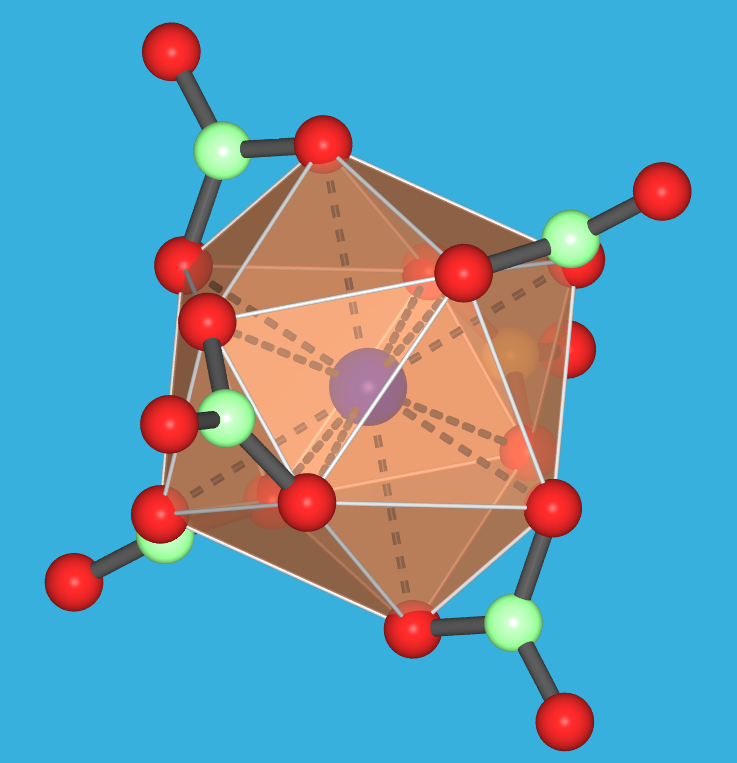 |
| Abb. 7.1.12. (NH4)2[CeIV(NO3)6] ('Ce(IV)-Ammoniumnitrat'): Foto des Salzes
und Struktur des Komplex-Anions.
‣VRML
|
|
Eigenschaften und Verwendung von Lanthanoid-Verbindungen
Für die Anwendungen sind die magnetischen und spektralen Eigenschaften der Lanthanoide
wichtig:
- Die 4f-Niveaus sind mit bis zu sieben ungepaarten Elektronen
besetzt, so dass die meisten Elemente einen starken Paramagnetismus aufweisen. Die experimentell
gemessenen Werte entsprechend den theoretischen Spin-Only-Werten (z.B. Gd: μeff=7.8 μB).
Im Festkörper (z.B. Legierungen mit Cobalt oder Eisen) folgt daraus ein starker kollektiver
Magnetismus (Ferro- bzw. Ferri-Magnetika).
- Im Unterschied zu den d-(Übergangs)-Metallen werden die f-Zustände hier nicht von der
chemischen Umgebung beeinflußt, so dass sehr scharfe Absorptionsbanden der
f⟶f-Übergänge und damit auch immer gleiche Farben auftreten. Die Energieunterschiede
der f-Niveaus resultieren dabei aus Spin-Spin- und Spin-Bahn-Kopplung. Sie können
für Laser (3/4-Niveau) und Lumineszenz-Pigmente genutzt werden.
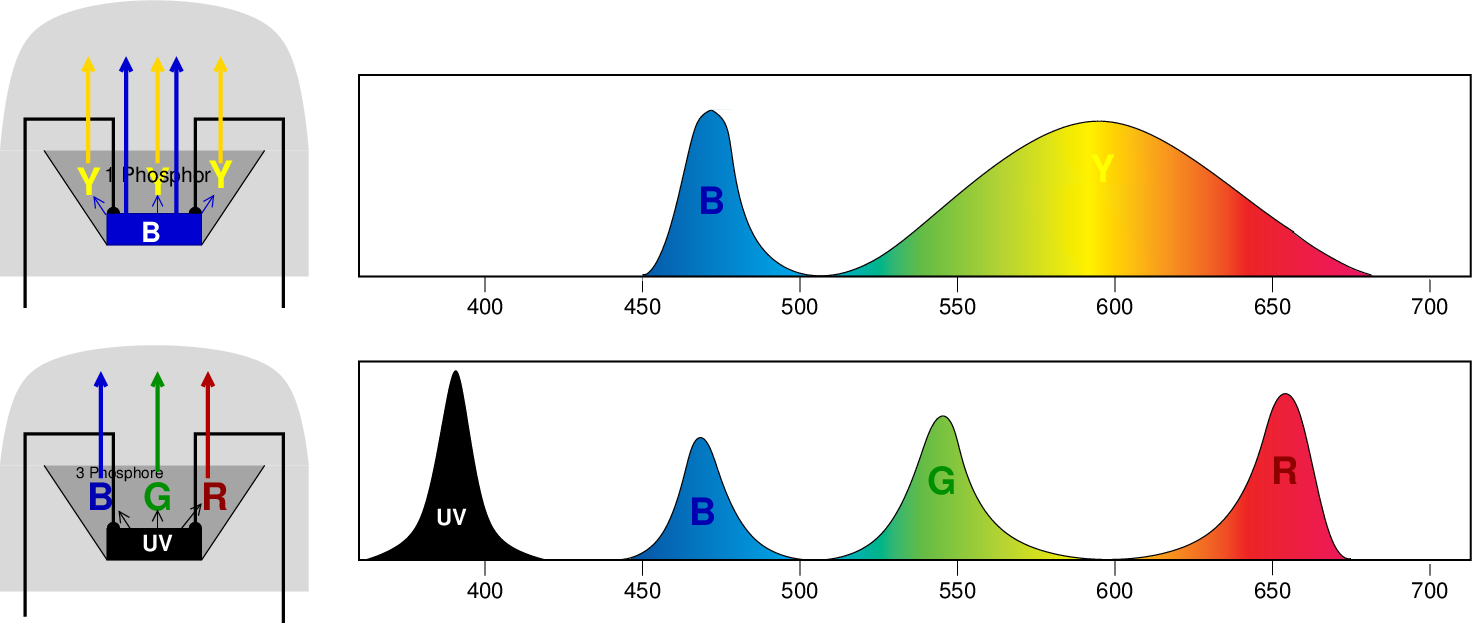
Z.B. zeigen Holmium-Salze (wie auch Ho-Oxid, s.o.) den sog. Alexandrit-Effekt,
d.h. sie erscheinen im Tageslicht gelblich, bei künstlichem (trichromatischem) Licht
dagegen blass rotviolett (s. Video).
Diese rotviolette Farbe ist eine Folge der
scharfen Bande von Eu3+-Ionen,
die in vielen trichromatischen Lichtquellen als rote Phosphore eingesetzt werden (s.u.).
 |
 |
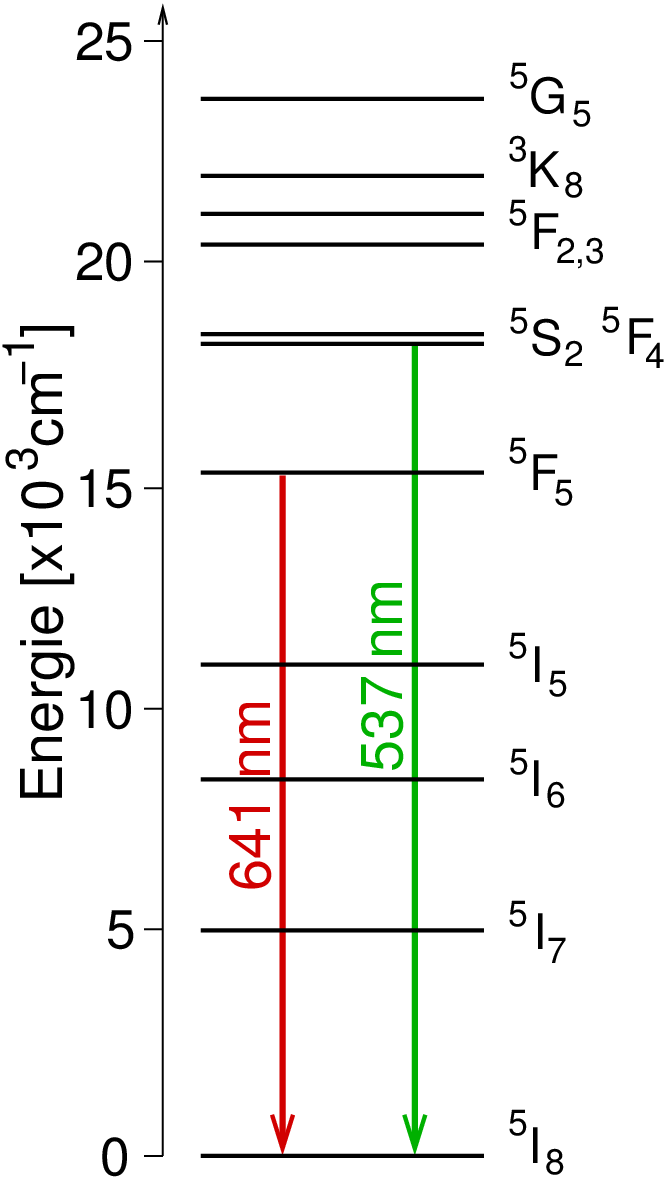
| Abb. 7.1.13. Term-Schema von Ho3+-Ionen
‣SVG |
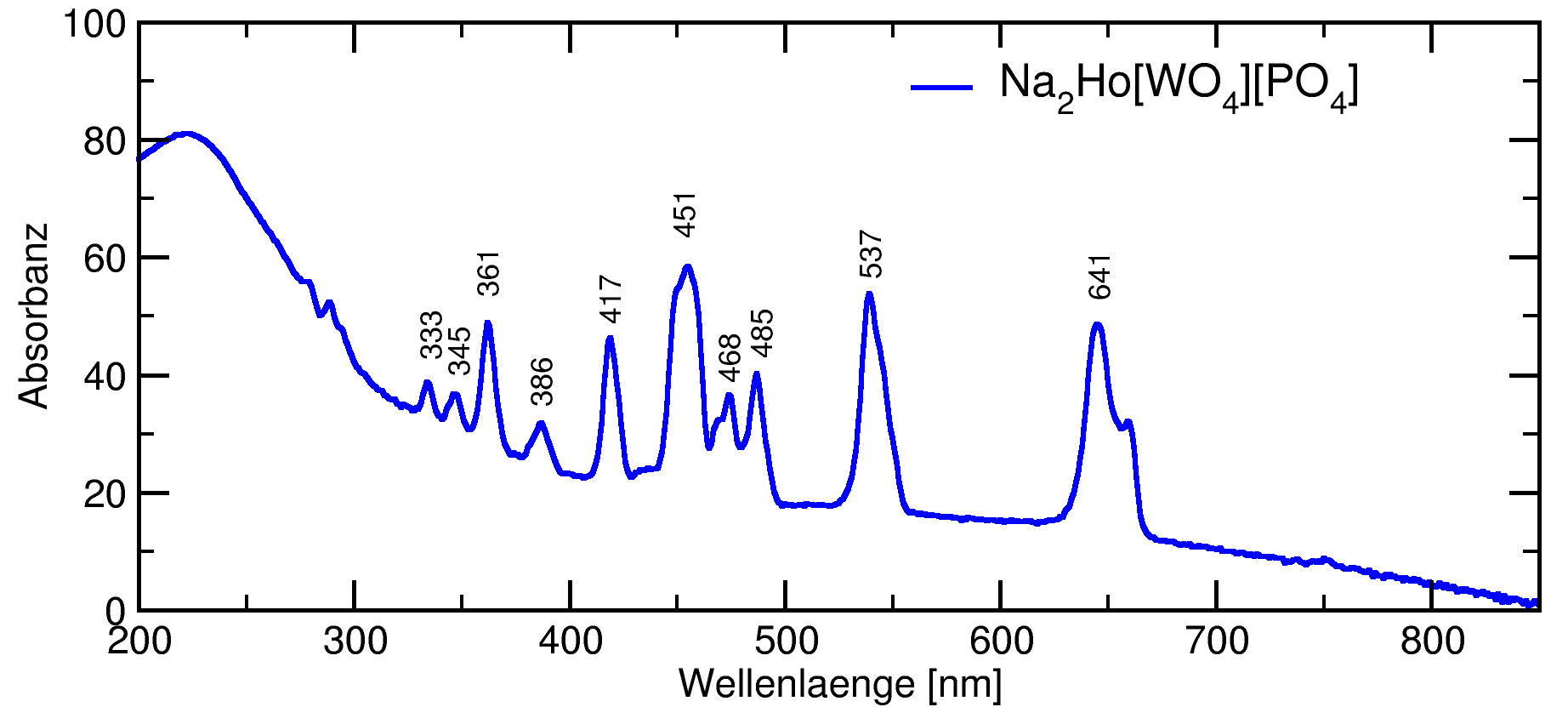
Abb. 7.1.14. UV/Vis-Spektrum von Na2Ho[PO4][WO4]
(Dank an M. Daub)
‣SVG |
| ⚗Farbwechsel eines Ho(III)-Salzes
(8MB|MP4|H264) |
|
|
Das Video zeigt das Ho-Salze im Wechsel
bei Tageslicht (Anregung mit dem kompletten weissen Spektrum, rote und grüne Anteile sind in der Emission reduziert,
das Salz erscheint blass gelblich)
und bei Beleuchtung mit einer trichromatischen Lichtquelle (deren
roter Eu(III)-Leuchtstoff schaltet den Übergang bei 641 nm aus und
man sieht nur noch die Komplementärfarbe des 537 nm-Übergangs, also magenta).
|
Das Termschema in Abbildung 7.1.13. zeigt, dass die Farbigkeit auf
f⟶f-Übergängen beruht. Die Aufspaltung der f-Niveaus kommt durch Spin-Spin- und
Spin-Bahn-Wechselwirkungen zustande und ist vom Ligandenfeld praktisch unabhängig
(im Unterschied zu den d-Niveaus!). Die Banden sind - verglichen mit typischen d⟶d-Banden -
auch extrem scharf (s. Abb. 7.1.14.). Zur Ableitung der Terme s. die Vorlesung
Methoden der Anorganischen Chemie, die entsprechenden PC-Vorlesungen
oder auch das Kapitel II: Atomare Eigenschaften
aus der Lanthanoid-Vorlesung.
Bedeutung und Verwendung einiger wichtiger Verbindungen nach
Elementen.
- Eine experimentell leicht zugängliche Mischung, sogenanntes 'Cermischmetall',
das aus Ce, La und Nd besteht, wurde früher in der Stahlindustrie als Sauerstoff-Getter
eingesetzt. Heute wird für diesen Zweck dagegen elementares Calcium verwendet.
 |
| Abb. 7.1.15. Cer-Mischmetall |
- Unter den Lanthanverbindungen finden Verwendung:
- La2O3 in hochbrechenden Gläsern.
- LaB6, ein elektrischer Leiter (vgl. CaB6)
als Elektronen-Emitter für Elektronenmikroskope.
- La-dotiertes BaTiO3 in PTC-Thermistoren (Überhitzungsschutz) (PTC=Positive
Thermal Coefficient).
- La-dotiertes PZT (Blei-Zirkonat-Titanat) wird als gutes Ferroelektrikum
(z.B. in Kondensatoren) eingesetzt.
- Die wichtigsten Verbindungen von Cer sind:
Abb. 7.1.18. CIE-Farbdreieck
‣SVG
bzw. etwas schicker hier
| ⚗ Filamentlampe
(8MB|MP4|H264) |
|
|
Das Video zeigt, wie in LED-'Glüh'birnen ein 'Glühfaden' simuliert wird,
in dem eine Reihe vieler kleiner blauer HL-LEDs den gelben Leuchtstoff
anregt und durch additive Farbmischung (blau+gelb) weisses Licht entsteht.
Diese Details sieht man nur, wenn man die Lampe langsam hochdimmt.
|
- Praseodym ist deutlich seltener als seine Nachbarn Cer und
Neodym. Die Hauptanwendung ist in Nd-Fe-B-Magneten, die i.A. direkt aus einer 3:1-Mischung
von Nd:Pr hergestellt werden. Die Abbildungen 7.1.19 und 7.1.20 zeigen
Fotos der Oxide von Praseodym.
 |
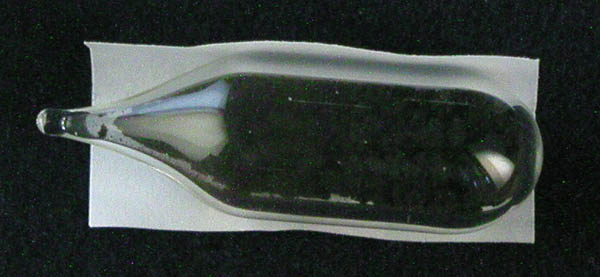 |
| Abb. 7.1.19. Pr2O3 |
Abb. 7.1.20. Pr6O11 |
Der Name 'Prasedym' (gr: prasios = grün; didymos = Zwilling) weist auf die Farbe
und die erst spät erfolgte Trennung von Neodym und Prasedoym (lange als 'Didym' gemeinsam bezeichnet)
hin.
- Neodym findet Verwendung in: